苏州碧迪医疗器械(BD)产品质量事件再次引起国家食品药品监督管理总局(以下简称“食药监总局”)关注。今年2月,食药监总局办公厅曾公开发函,责令上苏州碧迪医疗器械对飞行检查发现的问题进行整改。
6月22日,食药监总局发布通知,对英国Becton Dickinson and Company生产的一批存在质量安全隐患的真空采血管的查处工作做出安排。 6月29日,食药监总局发布了碧迪医疗器械(上海)有限公司(以下简称“上海碧迪”)对上述批次真空采血管主动召回的报告。
7月17日,记者联系上海碧迪方面寻求采访。不过,工作人员仅让本报记者留下联系电话,但截至发稿前一直都没有回应。
产品不合规
上述通知称,食药监总局近日收到国家质检总局办公厅通报,新疆出入境检验检疫局在进口医疗器械风险监测工作中,发现由英国Becton Dickinson and Company生产的批号为6166824真空采血管[注册证号:国械注进20152410400]管内、管壁有黑色异物,存在质量安全隐患。经新疆维吾尔自治区食品药品检验所检验,该批次真空采血管不符合“《真空采血管》YZB/BDP 010-2013”标准规定。目前,该产品代理人上海碧迪正在对该批次产品进行召回。
鉴于该批次产品涉及其他省市多家经营企业和使用单位,食药监总局为此要求上海市食品药品监督管理局依据《医疗器械召回管理办法》,对上海碧迪提交的召回计划进行评估,监督企业做好医疗器械召回工作,涉嫌违法行为的,依法立案查处。
通知还要求上海市食药监局加强对上海碧迪的监督检查,督促该企业履行代理人的相关职责,要求境外Becton Dickinson and Company对质量体系的运行情况进行全面自查,并于2017年7月21日前提交自查报告。并对该公司其他批次的真空采血管进行跟踪抽检。对流向其他省(区、市)的不符合标准的真空采血管,要立即通知相关省(区、市)食品药品监管部门协助做好产品召回的监督工作,防止危害扩大。
6月29日,食药监总局发布了上海碧迪对真空采血管主动召回的报告,表示涉及产品出现可见异物,影响产品正常使用。上海碧迪对上述批次真空采血管主动召回。涉及产品在中国的销售数量为943000支,提交召回报告日期为2017年5月12日。
事实上,近年来进口医疗器械的不合格率一直居高不下。2015年,天津空港检验检疫局共完成进口医疗器械检验监管1621批,货值6631万美元,其中检出不合格135批,货值873万美元,不合格率高达8.33%。2016年该局共检验进口医疗器械2253批,同比增长近四成;其中,检出不合格产品210批,不合格率近一成,创历年来新高。 2015年福建检验检疫局医疗器械不合格率则达到37.08%。
多次召回产品
公开资料显示,BD(Becton Dickinson)总部位于美国新泽西州,生产销售包括医用耗材、实验室仪器、抗体、试剂、诊断等产品。BD医疗2016年营收为124.8亿美元,在世界医疗器械百强企业当中排名第九。
1994年,BD正式派员在中国注册建立代表机构,开展对华业务。上海碧迪法定代表人邓建民为BD全球副总裁、大中华区总经理。
事实上,上海碧迪历史上曾发生多次产品召回事件。今年2月,上海碧迪对动脉采血器主动召回。2016年12月,上海碧迪报告,公司发现一部分产品出现防护罩脱离导致针头露出,增加了针刺伤的风险。公司决定召回相关批次一次性使用无菌注射针、一次性使用无菌注射器(带针)。
2016年9月,因公司内部检查发现部分产品无菌包装开裂,不能保证产品无菌。上海碧迪对相关批次动脉采血器主动召回。2016年2月,上海碧迪对样本保存液主动召回。
值得关注的是,2017年2月10日,食药监总局办公厅致函上海食药监局,责令对上海碧迪和罗氏诊断产品(上海)有限公司飞行检查发现的问题进行整改。
食药监总局表示,根据《关于整治医疗器械流通领域违法经营行为的公告》部署,按照《药品医疗器械飞行检查办法》要求,该局组织对上海碧迪等企业进行了飞行检查,发现上述企业存在不符合《医疗器械经营质量管理规范》的问题。
食药监总局为此要求上海食药监局责令企业限期整改,并监督企业切实整改到位。企业整改情况及上海食药监局采取的监管措施须及时在上海食药监局网站上发布,并于2017年3月7日前将整改后复查情况报总局医疗器械监管司。
附件显示,碧迪医疗器械(上海)有限公司不符合《医疗器械经营质量管理规范》的问题有以下两个,“企业销售人员黄某某授权书未加盖公司印章。企业对批号为5064679等6批产品采取召回措施,产品销毁记录中,企业记录的销毁数量单位为公斤,第三方销毁公司记录的销毁数量单位为支,两者不一致”。
2017年3月9日,上海食药监局致函食药监总局办公厅表示,针对食药监总局飞行检查组在2016年11月29日至2016年12月2日对碧迪医疗器械(上海)有限公司等两家企业飞行检查时发现的问题,上海食药监局高度重视,立即责令企业限期整改,两家公司于2016年12月份先后提交了整改资料。
2017年1月11日,浦东新区市场监督管理局对两家企业进行跟踪检查,目前已确认全部整改到位,跟踪检查情况已在上海市浦东新区市场监督管理局政务网上进行公示。
有业内人士认为,食药监总局年内两次公开发函关注同一家跨国大企业的质量安全事件,历史罕见,这意味着国家层面对医疗器械监管的进一步趋严,相关企业需要警惕。
苏州碧迪医疗器械公司简介
美国BD公司在中国的生产工厂--苏州碧迪医疗器械有限公司座落于苏州工业园区美丽的金鸡湖畔,1995年8月奠基,1996年10月26日正式落成。中国副总理李岚清和新加坡副总理李显龙参加了隆重的公司落成典礼。
苏州碧迪总投资2,500万美元,占地面积2万平方米,厂房面积1万平方米。拥有十万等级洁净室面积2,200平方米。1998年6月获得ISO9002和ISO13488国际质量认证,1998年12月获得欧共体CE标志,为苏州碧迪的产品进入欧洲市场提供了通行证
苏州碧迪主要生产BD医疗系统的产品,有一次性使用静脉留置针第二代(Insyte)和第四代(Intima-II)、一次性使用真空采血针组件(BCS)、一次性使用肝素帽(PRN)、一次性使用麻醉穿刺包( AS TRAY);及新一代一次性使用自毁型注射器SoloShotTM IX。Intima-II留置针是BD静脉留置针系列产品之一,是BD公司特别根据中国护士单翼持针的操作手法而设计的。它把套管、延长管和肝素帽整合在一起,针管侧孔的设计,柔软的导管为病人提供了安全舒适的静脉输液。苏州碧迪生产的联合麻醉包主要用于区域阻滞麻醉和疼痛管理。新一代SoloShotTM IX自毁型注射器是用于满足中国免疫接种对自毁型注射器的需求,支持卫生部、联合国儿童基金会和世界卫生组织的安全注射项目。目前全球不同的国家已有超过10亿次的疫苗注射采用BD的自毁型注射器。一次性静脉留置针、一次性使用麻醉穿刺包、一次性使用真空采血针组件(BCS)、一次性使用肝素帽(PRN)、SoloShotTM IX自毁型注射器均由进口组件装配而成。主要产品Intima-II型静脉留置针的关键部件,如针管、导管和隔离塞等也为进口组件。SoloShotTM IX自毁型注射器符合世界卫生组织的标准,并通过其检测和认证。联合麻醉包的主要原材料来源于美国碧迪公司。此外,苏州碧迪还将成为BD肝素帽产品的全球供应基地,工厂生产的硬膜外麻醉包还远销日本等国。

 猜你喜欢
猜你喜欢 数据显示:2021年国庆档新上
数据显示:2021年国庆档新上 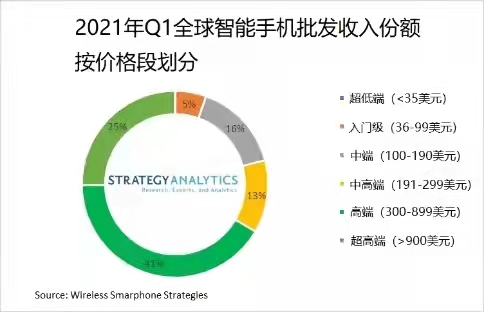 苹果、三星分食高端市场利润
苹果、三星分食高端市场利润  微信拟推出聊天记录付费云存
微信拟推出聊天记录付费云存  个人养老金制度加速崛起 金
个人养老金制度加速崛起 金  飞猪回应 “环球优速通被自
飞猪回应 “环球优速通被自  “泰康919,但愿人长久”:
“泰康919,但愿人长久”:  智慧物联,共赢无界 ——
智慧物联,共赢无界 ——  质保索赔、官网均关闭 卖了
质保索赔、官网均关闭 卖了