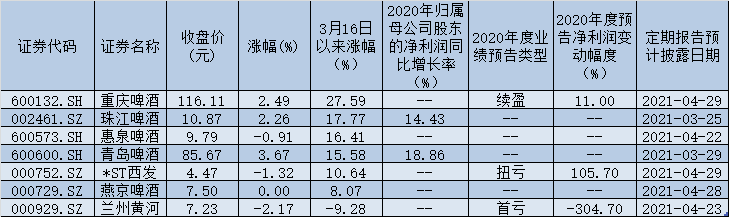
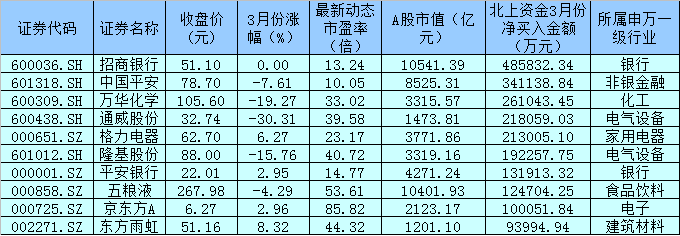
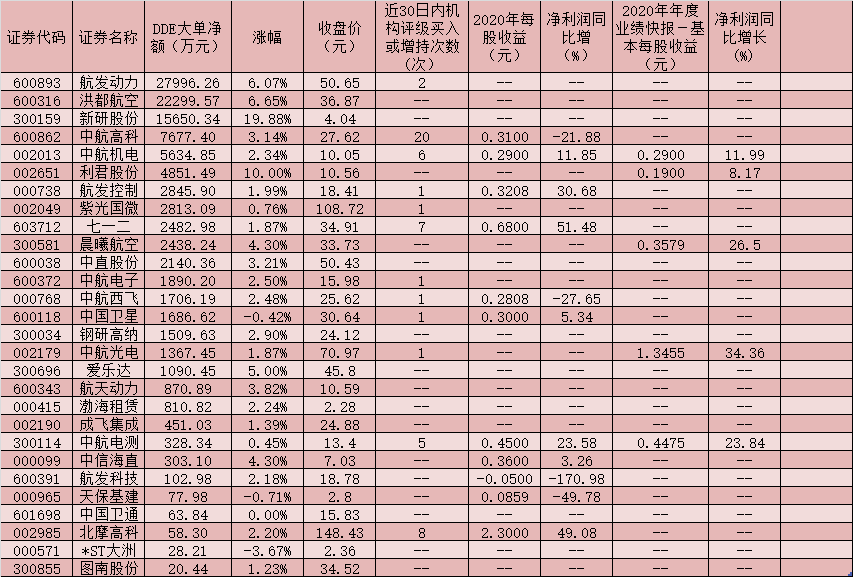
华东医药(000963.SZ)发布公告,于2021年3月8日,公司全资子公司杭州中美华东制药有限公司(简称“中美华东”)收到国家药品监督管理局(NMPA)核准签发的《受理通知书》(受理号:JXHL2100079国),由中美华东和美国MediBeacon,Inc.(简称“MediBeacon”)申报的1类新药MB-102注射液(Relmapirazin)临床试验申请获得受理。
据悉,MB-102是一种用于测量肾小球滤过率(简称“GFR”)的荧光示踪剂。该品经静脉注射入人体后,其产生的荧光信号能被MediBeacon经皮肾小球滤过率(以下简称“TGFR”)动态监测系统的传感器经皮捕捉,并通过软件算法将荧光信号的衰减率转化为GFR。通过MediBeacon全球首创的TGFR动态监测系统无创监测MB-102产生的荧光信号随时间的改变,可实时、动态反映GFR,供临床医生对患者的肾功能进行即时评估及诊断。

 猜你喜欢
猜你喜欢 数据显示:2021年国庆档新上
数据显示:2021年国庆档新上 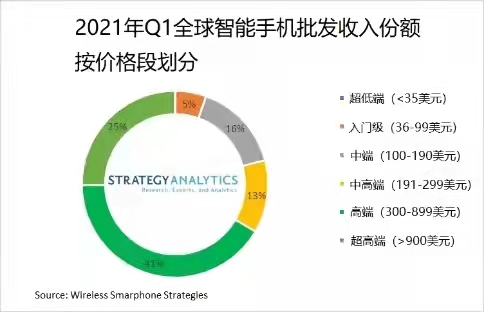 苹果、三星分食高端市场利润
苹果、三星分食高端市场利润  微信拟推出聊天记录付费云存
微信拟推出聊天记录付费云存  个人养老金制度加速崛起 金
个人养老金制度加速崛起 金  飞猪回应 “环球优速通被自
飞猪回应 “环球优速通被自  “泰康919,但愿人长久”:
“泰康919,但愿人长久”:  智慧物联,共赢无界 ——
智慧物联,共赢无界 ——  质保索赔、官网均关闭 卖了
质保索赔、官网均关闭 卖了